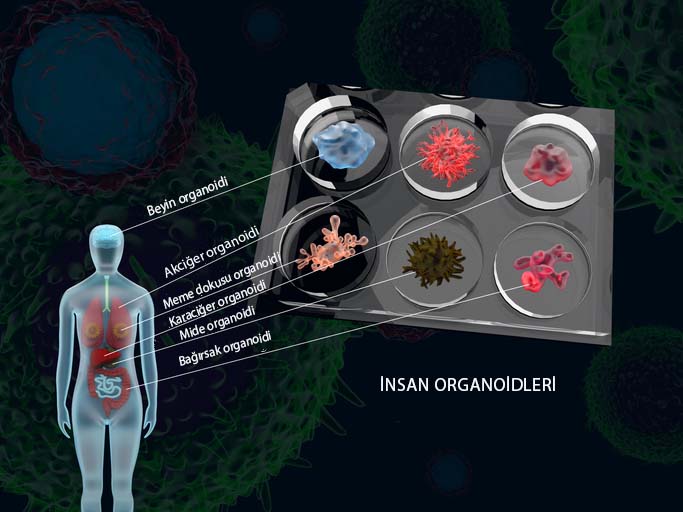
Organoidler: Hastalık Modellemenin Geleceği mi?
Bazı hastalıklar karşısında tıp dünyasının eli kolu bağlıdır, çünkü hastalığa karşı tedavi geliştirmek çok zordur. Kimi zaman hasta organdan alınan hücreler laboratuvar ortamında büyüyemediğinden, kimi durumlarda da organdan doku örneği alınamadığından, hastalığın nasıl oluştuğunu anlama ve olası tedavi yöntemlerini deneme şansı olmaz.
Fakat özellikle son 10 yıldır geliştirilen organoidlerle artık bir zamanlar “yapılamaz” denen bazı şeyleri yapabilmek mümkün.
Özellikle genetik temelli ve nadir görülen hastalıkların tedavisine kendini adamış birçok bilim insanının laboratuvarının baş aktörlerinden biri haline geldi organoidler. Organa benzeyen, laboratuvar ortamında dokudan ya da kök hücreden elde edilen ve organ gibi etkinlik gösteren üç boyutlu hücre grupları olarak tanımlayabileceğimiz organoidler, büyüme özelliklerini koruduklarından hastalıkların modellenmesinde araştırmacılar tarafından kullanılıyor. Yine de, bunları elde etmek benim diyen araştırmacılar için bile büyük bir uğraş ve başarı.

Yeni doğan bir bebekte nadir görülen, genetik temelli bir karaciğer hastalığı olduğunu düşünelim, maalesef bebekten karaciğer dokusu almak şimdilik mümkün olmadığından, hastalığın tedavisi için çalışmak da kolay değil. Fakat Koç Üniversitesi Tıp Fakültesi’nden Doç. Dr. Tamer Önder ve çalışma arkadaşları bu zorluğu aşmak için çalışıyorlar. İzmir Biyogenom ve Tıp Merkezi (İBG) ile ortak yürüttükleri TÜBİTAK 1003 Projesi kapsamında amaç, özellikle karaciğeri etkileyen ya da nadir görülen hastalıkların modellemesini yapmak.
Karaciğerdeki metabolizmayı etkileyen ve ölümcül olabilen ya da çok ciddi kalıcı hasarlara yol açan yaklaşık 20-25 kadar genetik bazlı hastalık var. Bu tür bir hastalık yeni doğan bir bebekte görüldüğünde, ne yazık ki bebekten karaciğer dokusu almak mümkün olmadığından hasta organ üzerinde çalışmak da mümkün olmuyor. Bir de üstüne hastalık nadir görülen bir türse, zaten pek fazla karşılaşılmadığı için hakkında çok fazla bilgi de olmuyor.
Dolayısıyla bu tür hastalıklara karşı ilaç geliştirmek ya da karaciğerdeki metabolizmayı anlamak istiyorsak, laboratuvarda çalışabileceğimiz bir hücremizin olması gerekiyor.
İşte, proje ekibinin hastaların derilerinden biyopsi örneği alıp karaciğer organoidi elde etmeleri bu konuda çok büyük bir adım atıldığının “resmi”dir.
Her ne kadar karaciğer hücreleri vücutta kendilerini yenileyerek harika işler çıkarsalar da, laboratuvar ortamında bu özelliklerini yitiriyorlar. Dolayısıyla eldeki hücreyi çoğaltmak mümkün olmuyor. Fakat Tamer Önder ve ekibinin yaptığı organoidler, karaciğer hücrelerinin bu makus talihini yenmiş; bunların sayıları artırılabiliyor, büyütülebiliyorlar. Böylece deneylerde ya da ilaç taramalarında kullanılmak üzere çok sayıda üretilebiliyorlar.
Hadi Bir Karaciğer Modelleyelim!
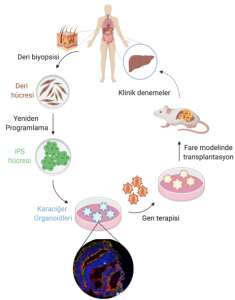 Ekibin yaptığı, öncelikle bir deri hücresi örneği alıp, Hücresel Yeniden Programlama Yöntemiyle onu plüripotent kök hücreye (iPS) dönüştürmek. Üzerinde çalıştıkları hastalık, sitrülin adlı bir amino asidin birikmesiyle oluşan ve hem anneden hem de babadan gelen genlerin bozuk olmasıyla ortaya çıkan sitrülinemi. Normalde hücrelerimizdeki fazla proteinler yıkıma uğradıktan sonra üre ve amonyak olarak vücuttan atılıyor. Bu işlem karaciğerde gerçekleşiyor; fazla proteinler amino asitlerine ayrılıyor ve o amino asitler de üre döngüsünden geçip amonyak ve üre haline geliyorlar. Bu işlerden sorumlu olan 5-6 enzim var. Eğer bu enzimlerin herhangi birinde bir bozukluk olursa, üre döngüsünü etkileyen hastalıklar ortaya çıkıyor. Bu hastalıklarda hastanın vücudunda amonyak ve üre birikmesi gerçekleşiyor. Amonyak birikmesininse özellikle sinir sistemine etkisi büyük; bebekler ve çocuklarda ölümle sonuçlanabiliyor.
Ekibin yaptığı, öncelikle bir deri hücresi örneği alıp, Hücresel Yeniden Programlama Yöntemiyle onu plüripotent kök hücreye (iPS) dönüştürmek. Üzerinde çalıştıkları hastalık, sitrülin adlı bir amino asidin birikmesiyle oluşan ve hem anneden hem de babadan gelen genlerin bozuk olmasıyla ortaya çıkan sitrülinemi. Normalde hücrelerimizdeki fazla proteinler yıkıma uğradıktan sonra üre ve amonyak olarak vücuttan atılıyor. Bu işlem karaciğerde gerçekleşiyor; fazla proteinler amino asitlerine ayrılıyor ve o amino asitler de üre döngüsünden geçip amonyak ve üre haline geliyorlar. Bu işlerden sorumlu olan 5-6 enzim var. Eğer bu enzimlerin herhangi birinde bir bozukluk olursa, üre döngüsünü etkileyen hastalıklar ortaya çıkıyor. Bu hastalıklarda hastanın vücudunda amonyak ve üre birikmesi gerçekleşiyor. Amonyak birikmesininse özellikle sinir sistemine etkisi büyük; bebekler ve çocuklarda ölümle sonuçlanabiliyor.
Ekip, Dokuz Eylül Üniversitesi Hastanesi metabolik hastalıklar grubunun eriştiği hastalardan alınan deri hücrelerinden iPS elde etmiş. Bu tip kök hücrelerin farklı hücrelere dönüşebilme yetenekleri olduğundan bunları önce hepatosit yani karaciğer hücresine dönüştürmüşler. Fakat görmüşler ki, daha önce kullanılan yöntemlerle elde ettikleri hepatositler büyümüyor ve bazı özellikleri de hepatosite benzemiyor.
Bunun üzerine üç boyutlu organoid yapmaya karar vermişler. Önce iPS’leri belli bir aşamaya kadar hepatositlerin öncü hücrelerine dönüştürüp sonra da 3 boyutlu büyüyebilecekleri bir ortama almışlar. Bu hücreler o ortamda kendi kendilerine bölünüp küremsi bir yapı oluşturmuşlar. Ayrıca bunların karaciğer hücresi olduğunu kanıtlamak için birtakım testler yapılmış; karaciğer tarafından salgılanan albümin gibi bazı proteinleri salgılayıp salgılamadıkları ya da karaciğer aktivitelerinden bazılarını yapıp yapmadıklarına bakılmış ve bunların hepatosit hücreleri olduklarından emin olunmuş. Dahası, karaciğer dokusundaki belirli bir üç boyutlu organizasyon yapısına çok benzer bir organizasyon oluşmuş; hücrelerin birleştiği yerlerde normalde olması gereken yapıların da oluştuğu gözlemlenmiş.
Bir sonraki aşamada, hasarlı karaciğere sahip farelere laboratuvar ortamında üretilmiş ve yeşil floresan proteinle işaretli bu insan karaciğer hücreleri damar yoluyla nakledilmiş. Farenin karaciğerindeki hasarlı bölgelere yapışan hücreler orada büyümeye başlamış. Bütün bu denemelerin nedeni, ileride aynı işlemi insanlarda gerçekleştirebilmek. Hasta birinin derisinden alınan ve iPS vasıtasıyla hepatosite özelleştirilen hücrelerin daha sonra tekrar hastaya başarılı bir şekilde nasıl nakledileceğini ve hücrelerin orada çoğalacağını sınamak açısından bu deneyler önemli. Fakat burada, bu hastadaki genetik mutasyonun düzeltilmesi ya da eksik olan proteinin tekrar kazandırılması da çok önemli.
Deneylerde, hastalıklı hücrelerde ASS1 adlı enzimin fonksiyonunun olmadığını görmüşler ve viral vektörler kullanarak enzimi hücreye geri koyabilmişler. Böylece organoidlere de bu genin normal kopyasını yerleştirmeyi başarmışlar. Böylelikle, üre dengesi bozuk olduğu için fazla amonyak salınan hücrelere bozulan genin normal kopyası verildiğinde amonyak seviyesinin düştüğünü görebilmişler. Bunun diğer adı, hücreyi gen tedavisiyle iyileştirmek!
Bu tedavi edilen organoidi farelerde hasta karaciğere yerleştirmişler. İleride yapılması beklenen de bu organoidin hastalıklı dokuya yapışıp orada beklenen kimyasal aktiviteyi göstermesi, yani protein yıkımında döngüyü tamamlaması ve amonyak seviyesinin azaltılmasını sağlaması. Fakat şimdilik hasta bir karaciğerde hücrelerin ne kadarının bu organoidlerle yer değiştirmesi gerektiği bilinmediğinden henüz bu nakli gerçekleştirmek için erken.
Ama diyelim ki, bu hastalıklı organda artan amonyak seviyesini düşürecek bir molekül bulunabilse ve bu molekül de bir ilaç haline getirilip hastaya doğrudan verilse… Bu kadar zahmete girilmeden hasta tedavi görür. İşte bu molekülün belki de yüz binlerce molekül arasından bulunabilmesi ancak böyle bir hastalık modelinin ortaya çıkarılmasıyla mümkün olabilirdi. Yani Tamer Önder ve ekibinin yaptığı bu çalışma ilaç endüstrisi için bazı kapıları aralayabilecek.
Bir başka deyişle bu, iPS ile kök hücreden karaciğer hücresi eldesi bir kere başarıldı mı, karaciğerle ilişkili birçok başka hastalığın da tedavisi için umut ışığı olabilir anlamına geliyor. İşte bütün bu karmaşık ve zahmetli çalışmaların sonunda ekip bunu başarmış! Bir sonraki hedef, tedavi edilen organoidin yerleştirildiği karaciğerde vazifesini başarıyla yapması ve üre döngüsünün başarıyla tamamlanmasını sağlamak.
Fakat yukarıda söylediğimiz gibi, bu kapı bir kere açıldı ve bundan sonra karaciğer hastalıklarının araştırılması ve tedavisinde araştırmacılar için bir altın anahtar yapıldı bile.
REFERENCES
- 1. Akbari S*, Sevinç GG*, Ersoy N, Basak O, Kaplan K, Sevinç K, Ozel E, Sengun B, Enustun E, Ozcimen B, Bagriyanik A, Arslan N, Önder TT*, Erdal E*. (2019) Robust, Long-Term Culture of Endoderm-Derived Hepatic Organoids for Disease Modeling. Stem Cell Reports. 13(4):627-641.
