
2022 Nobel Kimya Ödülü “Klik” Kimyasının
Bu yılın kimya dalındaki Nobel Ödülü, klik kimyası ve biyoortogonal kimyanın geliştirilmesini sağlayan Carolyn R. Bertozzi, Morten Meldal ve K. Barry Sharpless’a verildi.
Lego bloklarının nasıl hızlı bir şekilde ve kolayca birleşebildiklerini düşünün. Şimdi, bu blokların moleküler yapı taşları olduğunu hayal edin. Karmaşık molekülleri inşa etme fikri kimyagerler için daima heyecan verici olmuştur; çünkü bunun anlamı, istenen özelliklere sahip doğal molekülleri yapay olarak yeniden yaratabilmek demektir -özellikle de tıbbi veya ekonomik öneme sahip olan molekülleri. Fakat bu, normalde oldukça karmaşık bir süreçtir; çok zaman alır ve pahalıdır da. Neden mi? Öncelikle, bileşiklerin farklı parçalarını nasıl bir araya getirebileceğinizi çözmeniz gerekir. Bunu yaparken, doğru ürünü oluşturmak için atomları doğru şekilde birbirine bağlayan gerçek ve işlevsel kimyasal bağlar oluşturmanız şarttır. Bunun yanında, her adımda ortaya çıkan ve sürecin geri kalanına devam edebilmek için uzaklaştırılması gereken istenmeyen yan ürünler meselesi de var.
Sharpless ve Meldal, bu karmaşık süreci kolaylaştıracak bir yöntemin temelini attılar. Klik kimyası olarak bilinen bu yeni fonksiyonel kimya şekli, molekülleri tıpkı Lego blokları gibi birleştirmeyi mümkün kılıyor. Bu süreçte kimyasal tepkimeler hızlı bir şekilde ve istenmeyen yan ürünler ortaya çıkmadan gerçekleştirilebiliyor.
Klik kimyası kavramını ilk ortaya atan Barry Sharpless oldu. Bu yeni ve minimalist yaklaşım, 2000 yılı civarında, farklı molekülleri birleştirmek için karbon atomları arasındaki bağları kullanmak yerine ekibiyle birlikte alternatif yöntemler aramaya başladığında şekillendi. Birbirine bağlanmış karbon atomları, bilinen tüm biyomoleküllerin temel iskeletini oluşturur; ancak bu atomları başka bir molekülün karbon atomlarıyla bağ oluşturmaya ikna etmek zordur. Yapay olarak aktive edilmeleri gerekir ki bu süreç sıklıkla çok sayıda istenmeyen yan tepkimeye, bir sürü arzu edilmeyen yan ürüne ve masraflı bir malzeme kaybına yol açar. Bu noktada Sharpless, işe başlamak için karbon iskeletleri tamamlanmış olan, daha küçük ve daha basit molekülleri kullanmayı, bu molekülleri birbirine bağlamak için de kontrolü daha kolay olan azot ya da oksijen atomlarını kullanmayı denemeyi önerdi.
Bu kadar basit kimyasal yapı taşlarını birleştirmek neredeyse sınırsız çeşitlilikte moleküller oluşturmayı mümkün kılabilirdi, endüstriyel ölçekte bile. Ancak bir kimyasal tepkimenin klik kimyasına örnek kabul edilebilmesi için belirli kriterler de vardı. Bunlardan biri de tepkimenin oksijen varlığında ve su içinde gerçekleşebilmesi gereğiydi.
Bir yıldan biraz daha uzun bir süre sonra hem Sharpless hem de Morten Meldal, birbirlerinden bağımsız olarak, günümüzde klik kimyasının baş tacı kabul edilen özel bir kimyasal tepkimeyi sundular: bakır katalizli azid-alkin siklo-eklemesi.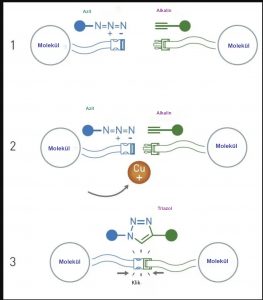
Meldal ve ekibi, yeni potansiyel farmasötik maddeler keşfetmek amacıyla farklı moleküller kullandıkları sırada, rutin olarak yürüttükleri bir tepkimede beklenmedik bir fenomen gözlemlediler. Tepkimedeki bir molekül (bir alkin), diğer molekülün (bir azit) yanlış ucuna bağlanmaya karar vermişti ve bu garip bağlanma sonucunda beklenmedik bir halkasal moleküler yapı ortaya çıkmıştı. Meldal, bu olayda bakır iyonlarının rol oynadığını fark etti. Bakır iyonlarının tepkime üzerindeki bu kontrolü, birçok farklı molekülü birbirine bağlamak için de kullanılabilirdi. Aynı yıl Sharpless da azitler ve alkinler arasında gerçekleşen bakır katalizli bir tepkime üzerine bir makale yayınladı ve suda da gerçekleşen bu tepkimeyi “ideal” bir klik tepkimesi olarak nitelendirdi. İki farklı molekülü birbirine bağlamak isteyen kimyacılar, artık kolayca moleküllerden birine bir azit ve diğerine de bir alkin ekleyerek, bu iki molekülü bakır iyonları yardımıyla birbirine bağlayabiliyorlar.
Bunu takip eden yıllarda Carolyn Bertozzi, klik kimyasını yeni bir boyuta taşıdı ve hücre yüzeyindeki belirli biyomolekülleri haritalamak için kullanmaya başladı. Biyoortogonal (yani normal hücre kimyasını bozmadan canlı organizmaların içinde çalışan) klik tepkimeleri geliştirdi. Bu tepkimeler günümüzde kanser çalışmaları dâhil birçok alanda kullanılıyor. Birçok araştırmacı şu anda kanseri teşhis ve tedavi etmenin yeni yolları üzerinde çalışmak için bu tepkimelerden yararlanıyor.
Genellikle proteinlerin ve hücrelerin yüzeyinde bulunan karmaşık yapılı karbonhidratlar olan glikanlar, hücrenin enfekte oluşu ve bağışıklık sisteminin harekete geçişi dâhil birçok biyolojik süreçte önem taşır. Carolyn Bertozzi, 1990’ların başında, bağışıklık hücrelerini lenf düğümlerine çeken belirli bir glikan tipinin haritasını çıkarmak için zorlu bir çalışmaya başlamıştı. Çalışmaları devam ederken, bir Alman araştırmacı da hücreleri, glikanların yapısına giren bir şeker molekülünün doğal olmayan bir varyantını üretmeye ikna etmeyi başardı. Bertozzi’nin aklına, kendi şeker molekülünü üretmek için benzer bir yöntem kullanma fikri geldi. Hatta belki de bu moleküllere, glikanların hücrede nereye gittiğini görmek için takip edebileceği özel bir kimyasal tanıtıcı ekleyebilirdi. Bu kimyasal tanıtıcı biyoortogonal olmalıydı. Yani, yalnızca bağlı olduğu moleküle özgü olmalı, başka herhangi bir madde ile tepkimeye girmemeli ve bu sayede de hücrede gerçekleşen doğal biyokimyasal süreçlere müdahale etmemeliydi. Önce 1997’de fikrinin gerçekten işe yaradığını kanıtladı ve 2000 yılında da en uygun kimyasal tanıtıcıyı bulmayı başardı: bir azit.
Bulgularını Meldal ve Sharpless’ın klik kimyasıyla harmanlayan Bertozzi, ikilinin ünlü tepkimesinin bakır içermeyen bir şeklini oluşturmayı başardı (çünkü bakır, biyolojik sistemler için toksik özellikteydi) ve sonra da bunun glikanları izlemek için kullanılabileceğini gösterdi.
Klik kimyası ve biyoortogonal tepkimeler, kimyada sadelik ve işlevsellik çağını başlatarak, her türlü yapıyı yapay olarak üretebilmemizi sağladı -neredeyse hayal edebileceğimiz her şeyi. Bu yöntemler sayesinde maddeleri artık antibakteriyel özellik taşıyan, elektriği iletebilen, güneş ışığını soğurabilen veya ultraviyole radyasyondan koruyabilen -aklınıza gelen her türlü özelliğe sahip her türlü başka maddeyle- zenginleştirmek mümkün.
Farklı tümör tiplerini hedefleyen “klik edilebilir antikorlar” da geliştiriliyor. Antikorlar tümöre bağlandığında, ortama enjekte edilen ikinci bir molekül de klik tepkimesiyle antikora ekleniyor. Bu ikinci molekül, örneğin, bir PET tarayıcıda tümörlerin izlenmesine yardımcı olacak veya doğrudan kanserleşmiş dokuya ölümcül dozda radyasyon verebilecek bir radyoizotop olabilir.
REFERENCES
- 1. https://www.nobelprize.org/prizes/chemistry/
