Bir Virüs, Birçok Aşı, Birçok Soru…
İnsanlık, tarihi boyunca ölümcül hastalıklarla ve salgınlarla uğraştı. Bilim ve teknolojinin bebeklik çağını yaşadığı dönemlerde, bulaşıcı hastalıklar çok sayıda can aldı. Bırakın hijyen konusundaki bilgilerin azlığını, yeterince temiz suya erişimin bile kısıtlı olduğu o günlerde ilaç tedavileri ve önleyici aşılar da yoktu. İnsanlığın şansı dünya nüfusunun şimdiki kadar kalabalık, uzun mesafeler arasında seyahatin de günümüzdeki kadar kolay olmayışıydı; yoksa muhtemelen kayıplar çok daha fazla olacaktı.
Ve an itibariyle, yaklaşık bir yıldır, tüm dünya yeniden bir pandemiyle mücadele ediyor. Çıplak gözle bile göremediğimiz küçücük bir virüs, gezegenin tüm gündemini ele geçirmeyi başardı. Ve nihayet, birçok ülkenin ortak çabasıyla, mücadeledeki üstünlük dengesini lehimize çevirmeye yaklaştık: Beklenen aşılar üretildi. Ancak, bu kez de yeni sorularımız oldu ve kendimizi kafa karıştıran bir bilgi kirliliği içinde bulduk.
Bir aşının güvenilir olduğuna nasıl karar veriliyor? Bu aşılar bizi ömür boyu koruyacak mı? Madem COVID-19 aşısını bir yıl içinde geliştirebildik, öyleyse neden bazı hastalıklar için hâlâ aşı yok? Mutasyonlar ne anlama geliyor? Bazı temel bilgileri aktarırken, bunlar gibi önemli soruları da hep birlikte ele alalım.
Virüsler nasıl organizmalar?
Tüm canlı hücreler, doğaları gereği çoğalırlar. Bölünürler ve genetik miraslarını, yani genomlarını sonraki nesillere aktarırlar. Virüsler degenoma sahiptir. Bu genom ya DNA ya da RNA yapısındadır. Ancak, bu molekülleri kopyalayıp yeni nesillere aktaracak mekanizmalara sahip değillerdir. Bu nedenle de başka bir canlı hücreye girer, onu ele geçirir ve kendilerini o hücreye kopyalatırlar. Enfeksiyon dediğimiz şey, işte budur.
Bir virüs, canlı bir hücreye giremediği sürece hiçbir şey yapamaz. Genom taşıyan, durağan bir parçacıktan ibarettir. Virüs genomu “kapsid” adı verilen, protein yapıda bir kılıfla çevrilidir. Bazı virüslerde buna ek olarak “zarf” adı verilen, lipid yapıda ikinci bir kılıf bulunur. Virüslerin yüzey proteinleri, hücre zarlarında bulunan belirli reseptörlere bağlanır. Bu reseptörleri taşımayan hücrelere virüs giremez. Bu nedenle, her virüs her canlıyı enfekte edemez. Ayrıca, bir canlının vücudundaki her hücreyi de enfekte edemez. Bulaş yolu da buna göre değişir.
Örneğin, COVID-19 etkeni koronavirüsün (SARS-CoV-2) hücreye girebilmesi için hücre zarında ACE2 reseptörü bulunmalıdır ve virüs yüzeyindeki topuz biçimli proteinler (Spike proteinleri) bu reseptörlere bağlanmalıdır.
Virüslerin hücreye giriş şekilleri, hücreye girdikten sonra ne yaptıkları ve enfekte olan canlının buna nasıl bir tepki verdiği farklılık gösterebilir. Her enfeksiyon mutlaka hastalığa yol açacak diye bir şart yoktur. Hatta bazı virüsler, enfekte ettikleri canlıya fayda bile sağlarlar. Ama eğer hücre içinde ve dışında çok sayıda tepki ortaya çıkıyorsa, hatta vücut içinde çok sayıda farklı hücre tipinin rol oynadığı bir bağışıklık yanıtı oluşuyorsa, işte o zaman hastalık semptomları görülür.
Virüslerin neden olduğu en ölümcül bulaşıcı hastalıklar hangileri?
Başlığı görür görmez, çoğunuzun aklına belli başlı hastalıklar gelmiştir: Çiçek, grip, kızamık, kuduz, Ebola, AIDS… Bu hastalıkların hepsi de ölümcül; hatta kuduz hastalığı, semptomları ortaya çıkmaya başladıysa neredeyse %100 ölümcül. Neyse ki, hemen hepsine yönelik koruyucu aşılar mevcut. Bunlar arasında çiçek aşısı özel bir yere sahip. Dünya çapında uygulanan başarılı aşılama programları sayesinde 1980 yılında çiçek hastalığının “eradike” olduğu ilan edildi, yani bu hastalık artık görülmüyor. HIV/AIDS içinse henüz bir aşı üretilebilmiş değil. Peki, neden?
Neden her virüs için kolayca aşı üretilemiyor?
Hastalık yapıcı virüslerin doğası ve davranışları, hem aşıların hem de ilaç tedavilerinin etkinliğini doğrudan etkiler. Genel olarak RNA virüsleri daha zorlayıcıdır. DNA virüslerinden çok daha kolay ve çok daha hızlı mutasyon geçirirler. Bu da, etkili aşıların üretimini zorlaştırır ve bazı durumlarda aşıların belirli aralıklarla yeniden üretilmesini gerektirir. Mevsimsel grip aşıları, işte bu nedenle 6 ayda bir güncellenerek yeniden üretilir.
Zarf yapısına sahip virüsler farklı bir strateji izlerler. Konak hücrenin içinde oluşturulan yeni virüs kopyaları, hücre dışına çıkarken, konak hücrenin zarıyla kaplanırlar. Yani, vücutta çoğalan virüslerin zarfları, konak canlının hücre zarıyla benzer yapıdadır. Bu sayede, belirli bir aşamaya dek, kendilerini konak canlının bağışıklık sistemine karşı koruyabilirler. Yeni bir hücreye girmek için tek yapmaları gereken de, zarflarını o hücrenin zarıyla kaynaştırmak olur.
Retrovirüsler ise ekstra zorluk çıkarırlar. Bu virüsler, hücreye girdikten sonra kendi RNA’larından kopyalayarak ürettikleri DNA parçasını, konak hücrenin kromozomal DNA’sına eklerler. Bir kez enfekte olan hücre, virüs genomunu kendi DNA’sından ayıramaz ve ömrü boyunca virüs proteinlerini sentezlemeye devam eder. Bu hücre çoğalırsa, yeni oluşturduğu tüm hücreler için de aynı durum geçerlidir. Şimdiye dek lisanslı bir HIV aşısına sahip olamayışımızın en önemli nedenlerinden biri, HIV’in de bir retrovirüs olması. Bu yüzden AIDS hastaları tedavi desteği alabiliyor ama HIV enfeksiyonu vücuttan tamamen temizlenemiyor.
Peki, ya diğer hastalık yapıcılar?
Yararlı, hatta olmazsa olmaz kabul edilen birçok bakterinin varlığına karşın, bazı bakteriler de insanlarda ölümcül bulaşıcı hastalıklara neden olabilirler. Bunların belki de en ünlüsü, hıyarcıklı veba. Tıpkı çiçek ve grip gibi, bu hastalık da tarih boyunca farklı zamanlarda, farklı bölgelerde tekrar tekrar ortaya çıktı ve çok sayıda insanın ölümüne neden oldu. Doğru hijyen uygulamaları ve düzgün beslenme sayesindeyse uzun zamandır kontrol altında. Geliştirilen çok sayıda antibiyotik de, çoğu durumda, kolayca tedavi şansı sağlıyor.
Virüsler ve bakteriler dışında viroidler, protozoalar, prionlar, bazı mantarlar, hatta parazitik yaşayan bazı omurgasızl ar ve böcek larvaları da insanlarda hastalıklara neden olabiliyor
ar ve böcek larvaları da insanlarda hastalıklara neden olabiliyor
Aşıların amacı nedir, nasıl üretilirler?
Bağışıklık sistemi, hastalık yapıcı bir organizma tespit ettiğinde ona karşı yanıt oluşturur. Vücudun ilk tepki olarak ürettiği bağışıklık sistemi hücrelerine ek olarak, esas güçlü yanıt, hastalık yapıcıda bulunan antijenlere karşı antikorlar üretmektir. Aşıların amacı, aktif bir hastalık yapıcı vücuda girmeden önce, vücudun ona karşı antikor oluşturmayı öğrenmesini sağlamaktır.
Aşılarda, hastalık yapıcı organizmanın zayıflatılmış veya inaktive edilmiş hali, bazen de bazı bileşenlerinin laboratuvarda üretilmiş kopyaları bulunur. Şimdiye dek geliştirilmiş ve uygulanmış olan tüm aşılar, bu yöntemlerden biriyle üretilmiştir. Aşı içeriği hücrelere girdikten sonra çoğalarak hücre dışına çıkar ve bağışıklık yanıtını tetikler. Böylece, vücut hastalık etkeniyle “tanışmış” olur. Aşının etkinliğine bağlı olarak, vücut belirli bir süre bu tanışıklığı hafızasında tutar ve gerçeğiyle karşı karşıya geldiğinde ne yapması gerektiğini bilir. (COVID-19 aşılarıyla ilgili ayrıntılı bilgi için Sağlık Bakanlığı’nın ilgili sayfasını ziyaret edebilirsiniz.)
RNA aşısı nedir? Yepyeni bir teknik mi?
RNA aşı teknolojisinde, vücutta bağışıklık yanıtı oluşturabilmek için ölü ya da inaktif virüs parçaları yerine mesajcı RNA (mRNA) kopyaları kullanılır. COVID-19 aşısı için konuşursak, aşı içeriğindeki mRNA parçaları, virüsün yüzey antijenlerinin sentezini sağlayan şifreyi taşır. Yağ damlacığı benzeri kılıflar içerisine yerleştirilen bu mRNA’lar aşıyla hücrelere verilir ve hücrelerin içinde virüs antijenleri sentezlenir. Hücre dışına çıkan antijenler, vücut tarafından görüldükleri anda da bağışıklık yanıtı oluşmaya başlar.
Tekniğin üzerinde 20 yılı aşkın süredir çalışılıyor ve bu teknikle daha önce geliştirilmiş (ama klinik çalışmaları henüz bitmemiş) olan başka aşılar da var. Yani, kesinlikle yepyeni bir teknik değil. Fakat çığır açan bir teknik olduğu kesin. Çok fazla miktarda aşının, çok kısa zaman içinde üretilebilmesini sağlıyor. Ayrıca, virüsler dışındaki hastalık etkenlerine karşı da aşı üretiminde kullanılabiliyor. Bu teknik sayesinde, bir sonraki pandemi için çok daha hazırlıklıyız.
Faz 1, Faz 2, Faz 3 ne anlama gelir?
İlaçların ve aşıların tasarımı, geliştirilmesi ve ilk örneklerinin üretimi yıllarca sürebilir. Üretilen her ilaç veya aşı, yaygın kullanıma sunulmadan önce yan etkileri ve koruyuculuk oranı açısından araştırılır. Bu araştırmanın bir kısmı bilgisayar başında ve/veya laboratuvarlarda yürütülür. Bunların tamamı “klinik öncesi çalışmalar” olarak bilinir. Deneysel aşılar, güvenli olduklarını ve hastalığı önleyebildiklerini görebilmek için hayvanlar üzerinde de test edilir. Sonraki adımsa, gerçek insan vücudundaki etkileri görmektir. Faz 1, 2 ve 3 de bu noktadan itibaren başlayacak olan, üç aşamalı klinik denemeleri ifade eder.
Klinik denemeler izne tabidir. Yetkili kurumlarca onay verilmeden hiçbir ilaç veya aşı için klinik çalışmalara geçilemez. Güvenlik ve güvenilirlik açısından, denemelere az sayıda katılımcıyla başlanır ve her aşamada bu sayı artar.
Faz 1: Sınırlı sayıda katılımcıyla yürütülür. Öncelikli amaç, aşının güvenli olup olmadığını görmektir. Aşının bağışıklık yanıtı oluşturup oluşturmadığı ve ne dozda uygulanması gerektiği de bu aşamada belirlenir.
Faz 2: Yüzlerce kişiyle yürütülür. Aşının hem yan etkileri hem de yeterli bağışıklık yanıtı oluşturma başarısı yakın şekilde izlenip raporlanır. Bu aşamada bazı kişilere gerçek aşı yerine plasebo verilmesiyle, aşının etkileri konusunda karşılaştırma yapılır.
Faz 3: Aynı çalışma bu kez binlerce kişinin katılımıyla yapılır. Faz 3 çalışmalarının esas çıktısı, aşının hastalığı önlemede ne kadar etkin olduğudur. Ne kadar çok sayıda katılımcı olursa, o kadar güvenilir bir etkinlik oranı elde edilir. Bu aşamaya gelmiş bir aşının ciddi yan etkileri konusunda fazla endişe kalmamıştır; çünkü yaygın şekilde gösterebileceği yan etkiler önceki aşamalarda gözlenmiştir. Çok fazla kişide ciddi yan etkiler gösteren aşılar zaten bu aşamaya gelemezler. İstisnai durumlar elbette görülebilir ama kullandığınız en basit, reçetesiz ilaçlar için bile aynı olasılık geçerlidir.
Denemelerin tüm aşamaları, ilgili yetkili kurumlar tarafından izlenir ve veri takibi yapılır. Daha sonra, üretim yapılan ülkenin düzenleyici kurumuna tüm aşamaların verileri sunulur ve kullanım onayı için başvurulur. Etkinliği bu kurumca belirlenmiş oranın üzerinde olan ve ciddi yan etkiler gösterme olasılığı düşük olan aşılara onay verilir. Pandemi gibi acil durumlardaysa, acil kullanım onayı verilebilir. Tüm bunlardan sonra büyük ölçekte üretime geçilir. Aşılar, kullanılacakları her ülkede son bir kalite kontrolünden geçirilirler.
Bir aşının etkinliği ne kadar yüksek olmalı?
Kızamık hastalığını önlemek için geliştirilen aşı, an itibariyle bilinen en yüksek etkinlik oranına sahip: %97. Yani, aşılanan 100 kişiden sadece 3’ünün hastalığa yakalanma olasılığı var. Her yıl yeniden üretilen mevsimsel grip aşılarının etkinliğiyse %40-60 civarında. Aşının amacı, enfeksiyonu önlemekten ziyade, hastalığın ortaya çıkmasını önlemek veya olabildiğince hafif semptomlarla geçirilmesini sağlamaktır. Bu açıdan bakıldığında, dünya çapında kullanımı başlayan koronavirüs aşılarının tamamının etkinliği de çok iyi oranlarda diyebiliriz (hatta çoğu %90 üzerinde etkinliğe sahip).
Bu kadar kısa sürede bu kadar etkin aşılar nasıl üretilebildi?
Bu, gerçekten de bilim tarihinde ilk kez bu kadar hızlı tamamlanabilen bir aşı üretim süreci oldu. Normalde ilaç ve aşı üretiminin tüm aşamaları uzun zaman alabiliyor. Özellikle de klinik öncesi aşamalar. İşte tam bu noktada, bir koronavirüsle ilk kez karşı karşıya kalmadığımızı hatırlamamız gerek. Aynı virüs ailesi 2002 yılında SARS ve 2012 yılında da MERS salgınlarıyla dünyaya merhaba demiş, bu salgınlarla mücadele edebilmek için de birçok çalışma zaten başlatılmıştı. Bu sayede, klinik öncesi aşamalar sadece aylar içinde tamamlanabildi (normalde 5 yıl veya daha uzun sürebilir) ve aşılar hızla üretildi. Pandemi nedeniyle hem izin süreçleri hem de klinik çalışma aşamaları hızlandırıldı. Klinik çalışmalar normalde 6-7 yıl sürebilirken, aylar içinde tamamlandı ve acil kullanım onayı başvuruları yapıldı. Bu esnada, aşı üreticisi şirketler de inisiyatif kullanıp, onay başvurusu öncesinde büyük ölçekli üretime geçtiler. Bu, kendileri açısından bir riskti; çünkü aşıları onay almayabilirdi. Ama durumun acil niteliği ve dünyanın dört bir yanından ciddi miktarda aşı talebi olması nedeniyle bunu yine de yaptılar. İyi ki de yaptılar; bu sayede, acil kullanım onayları verilir verilmez aşıların tüm dünyaya dağıtımı başlayabildi.
Ya mutasyonlar?
Mutasyonlar, bir organizmanın genomunda yer alan DNA veya RNA moleküllerinin nükleotit diziliminde gerçekleşen değişimlerdir. Bir DNA ya da özellikle RNA molekülü her kopyalandığında mutasyon gerçekleşmesi ve mutant bir kopya oluşması ihtimali vardır. Her canlıda, her zaman. Mutasyonlar organizmaya zarar da verebilir fayda da sağlayabilir, bazen de etkisizdir. Canlıların karmaşıklık düzeyleri arttıkça, oluşan mutasyonları kontrol eden ve/veya ortadan kaldıran mekanizmalar da artar. Virüsler, yapılarından dolayı çok daha hızlı mutasyon geçirirler.
Hastalık yapıcılardaki mutasyonlar, araştırmacılar tarafından sürekli olarak izlenir. Bu mutasyonların görülme sıklıklarının artıp artmadığı ve ne gibi değişikliklere sebep oldukları takip altındadır. Artışa geçen ve hastalığın seyrini değiştirme potansiyeli taşıyan mutasyonlar çok daha yakından izlenir ve gerektiğinde, mutasyonun yayılmasını kontrol altına alabilmek için ek tedbirler alınır.
Yakın zamanda, SARS-CoV-2 virüsünün daha hızlı yayılmasına neden olduğu düşünülen bir mutasyon tespit edildi ve ek tedbir olarak, mutasyonun görüldüğü bölgelerde karantina uygulamaları sıkılaştırıldı. Bu mutasyonların, mevcut aşıların etkinliğini düşürmesi şimdilik beklenmiyor; çünkü aşılar çok yönlü bir bağışıklık yanıtı tetikliyorlar. Yine de, aksi söz konusu olursa, eldeki aşılar kısa zaman içinde uygun şekilde değiştirilebilirler.
Yeni koronavirüse geri dönecek olursak…
COVID-19’a neden olan koronavirüs, yani SARS-CoV-2, zarflı bir RNA virüsü. Yüzeylerinde ACE2 reseptörü taşıyan epitel hücrelerini hedef alıyor. Bu hücreleri ele geçirdikten sonra da, hem RNA molekülünü hem de yapısal proteinlerini bu hücrelere ürettiriyor. Yeni oluşturulan koronavirüsler, epitel hücrelerinin zarlarıyla “zarflanarak” hücre dışına çıkıyor ve enfekte edecek yeni hücreler aramaya başlıyorlar. Enfeksiyon belirli bir düzeye eriştiğinde bağışıklık sistemimiz harekete geçiyor ve hastalık semptomları başlıyor. Bağışıklık sisteminin aşırı tepki vermesi, ağır semptomlara neden olabiliyor ve zorlu bir tedavi gerektirebiliyor.
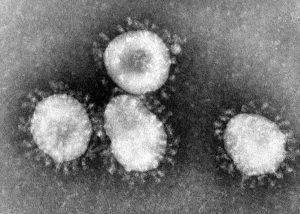
SARS-CoV-2 hem çok bulaşıcı hem de vücutta uzun süre belirti vermeden kalabiliyor. Bu iki özellik nedeniyle önümüzdeki tablo bu kadar ağır. Enfekte olduğunuzun farkında değilken, çok sayıda kişiye bulaştırabiliyorsunuz. Hastalığın seyri kimde ne kadar ağır olacak bilinemiyor ve ağır vakalarda kısa zaman içinde harika sonuçlar veren ilaçlar da ne yazık ki henüz yok. Eldeki mevcut ilaçları kullanıyor; etkilerine ilişkin yayımlanan raporlara göre devam ediyor veya başka bir ilaç adayına dönüyoruz.
Evet, aşıların Faz 3 klinik çalışmalarının takip süreci halen devam ediyor. Evet, aşıların farklı yaş gruplarında uzun vadedeki etkileri konusunda elde yeterince veri henüz yok. Fakat bu verilerin elde edilmesini bekleyecek kadar zamanımız da yok. Sağlık sistemleri üzerindeki yük ortada. Aşıların hepsi de çok uzun yıllara dayanan bilgi ve teknoloji birikimiyle, yeterince deneme-yanılma sürecinden geçirilmiş tekniklerle üretildi. Elimizdeki en mantıklı seçenek, kâr-zarar hesabına göre ilerlemek. Sonucun ne olacağı ve bu sonuca ne hızla ulaşılacağı bizlere bağlı: bireysel tedbirlerle küresel etki.
REFERENCES
- 1. https://www.who.int/emergencies/diseases/novel-coronavirus-2019
- 2. https://www.who.int/news-room/q-a-detail/vaccines-and-immunization-what-is-vaccination
- 3. https://www.cdc.gov/coronavirus/2019-ncov/vaccines/index.html
- 4. https://www.niaid.nih.gov/research/vaccine-types
- 5. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6777997/
- 6. https://www.ncbi.nlm.nih.gov/books/NBK21523/
- 7. https://www.medicalnewstoday.com/articles/158179
- 8. https://www.medicalnewstoday.com/articles/what-is-vaccine-efficacy
- 9. https://www.britannica.com/science/virus
